LES CLES DU DIMENSIONNEMENT
Ouvrages en commandePhotovoltaïque autonome
Photovoltaïque raccordé au réseau

Formations Professionnelles Photovoltaïques
Produit secondaire du procédé Chlore-Soudes
L’hydrolyse d’une saumure (eau salée) conduit à la production de soude NaOH, de chlore Cl2 et d’hydrogène H2. L’équation bilan de la réaction est la suivante :
NaCl + H2O → NaOH + ½ CL2 + ½ H2
Le procédé industriel initial utilisant du mercure a été abandonné pour des raisons environnementales. Il a été remplacé par le procédé à membrane. Les compartiments anodiques et cathodiques sont ici séparés par une membrane sélective conductrice de cations de 50 à 200 µm d’épaisseur. L’anode est alimentée par une saumure (concentration usuelle de NaCl : 180 à 200 g/L ; 1 < pH < 4,5). Celle-ci oxyde les ions Cl- en chlore gazeux Cl2. La cathode réduit l’eau en hydrogène gazeux H2. Les ions hydroxydes issus de la réaction se recombinent avec les ions Na+ qui ont migré du compartiment anodique vers la cathode, à travers la membrane (d’une surface usuelle de 1 à 3 m²), pour former de la soude dont la concentration avoisine 25 % en masse.
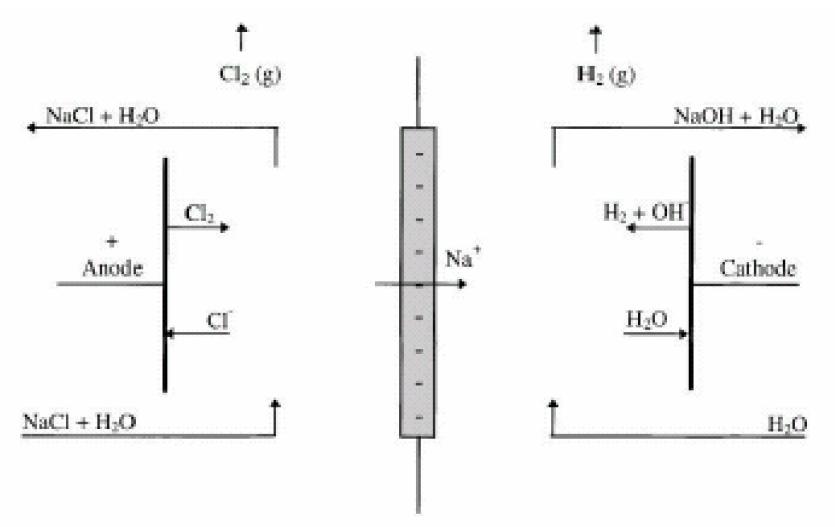
Représentation d’une cellule du procédé Chlore-Soude
Une différence de potentiel de 2 à 4 V est appliquée entre les deux électrodes afin d’ajuster le courant d’électrolyse (valeurs typiques : entre 2000 et 5000 A/m²). Une centaine de cellules sont habituellement assemblées en série pour former le stack. La température de fonctionnement varie entre 80 et 95 °C.