LES CLES DU DIMENSIONNEMENT
Ouvrages en commandePhotovoltaïque autonome
Photovoltaïque raccordé au réseau

Formations Professionnelles Photovoltaïques
Les frigorigènes et la couche d’ozone
L’ozone (O3) est un gaz toxique pour l’homme et présent dans l’atmosphère en très faible quantité. L’ozone présent est principalement concentré entre les altitudes 20 à 40 km (la stratosphère) et forme une couche filtrante des rayons ultra-violets : la "couche d’ozone". Sans cette couche, nous serions exposés au rayonnement solaire ultraviolet.
On classe le rayonnement ultraviolet en trois catégories selon la longueur d’onde :
- les UV-A (de 320 à 400 nm ) sont très peu absorbés par l’atmosphère. La plupart des UV-A traversent la couche d’ozone et atteignent la terre
- les UV-B (de 280 à 320 nm) sont en grande partie arrêtés par la couche d’ozone. Le rayonnement UV-B varie beaucoup dans la journée et est maximum vers midi
- les UV-C (de 200 à 280 nm) sont totalement arrêtés par la couche d’ozone
- les UV-B sont principalement responsables des "coups de soleil" !
- ils provoquent un vieillissement accéléré de la peau
- les UV-B à forte dose sont dangereux pour les yeux et peuvent provoquer une photokératite (flash du soudeur).
- ils affaiblissent le système immunitaire
- ils sont également à l’origine de certains cancers de la peau
Ces molécules agissent comme des catalyseurs et ne sont pas détruites par la réaction chimique. Elles sont donc stables et peuvent rester de 20 à 120 ans dans l’atmophère, voire plus. On estime qu’une molécule de chlore peut détruire jusqu’à 100 000 molécules d’ozone avant de disparaître.
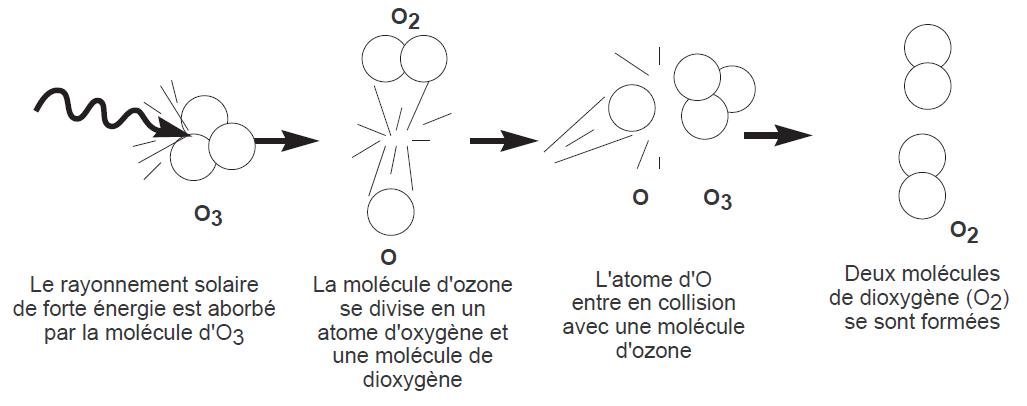
FIGURE 2.1 – Dégradation d’une molécule d’ozone en deux atomes d’oxygène par l’effet du rayonnement
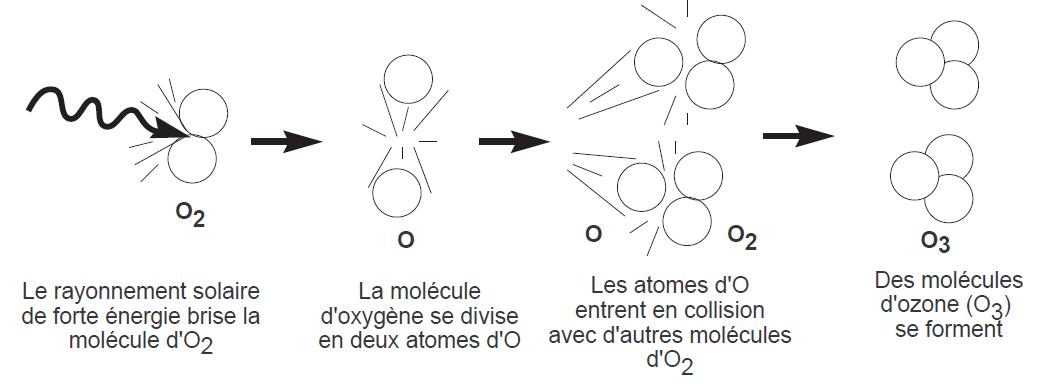
FIGURE 2.2 – Formation d’ozone à partir de l’oxygène
On recueille des données sur cette couche d’ozone depuis les années 50. La figure 2.4 présente l’évolution de l’épaisseur de la couche d’ozone au dessus de l’antarctique en unités Dobson (une unité Dobson correspond à 0.001 cm d’épaisseur) mesurée par le satellite Nimbus-7, et une deuxième mesure effectuée par les "instruments Dobson" au niveau du sol comme le font les scientifiques depuis les années 20. Dans les deux cas, on constate que la quantité d’ozone a été relativement stable jusque dans les années 1970. Depuis 1979, on assiste à un amincissement grave de la couche d’ozone au dessus de l’Antarctique.
L’effet des gaz frigorigènes CFC et HCFC est différent pour chaque gaz. L’ODP est un indice permettant de caractériser la participation de la molécule à l’appauvrissement de la couche d’ozone. Il est calculé par rapport à une molécule de référence (CFC11) auquel on attribue un indice de 1.
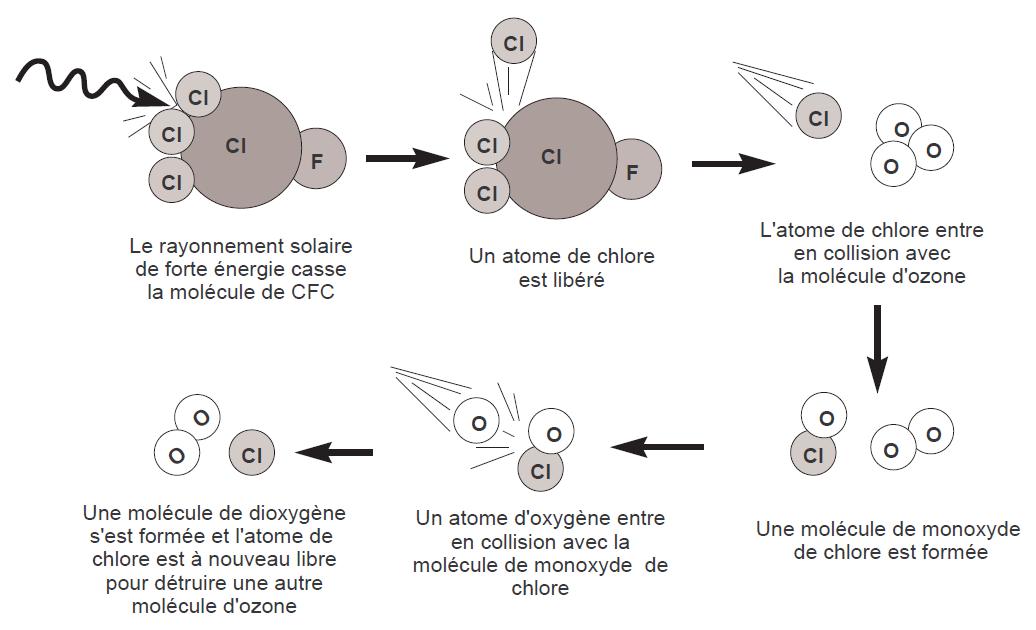
FIGURE 2.3 – La molécule de chlore est un catalyseur d’une réaction de dégradation de l’ozone