LES CLES DU DIMENSIONNEMENT
Ouvrages en commandePhotovoltaïque autonome
Photovoltaïque raccordé au réseau

Formations Professionnelles Photovoltaïques
Réglementation vis-à-vis de l'eau destinée à la consommation humaine
Contexte de la réglementation en matière d’eau destinée à la consommation humaine
Dès la fin du XIXème siècle, des textes ministériels évoquent le régime des eaux du point de vue de la salubrité publique. C’est ainsi que la circulaire ministérielle du 10 décembre 1890 précise que, pour apprécier la salubrité, l’analyse chimique d’une eau destinée à la consommation humaine doit être complétée par une analyse microbiologique même si les modalités ne sont pas précisées.
L’évaluation du risque microbien progresse dans les deux premiers tiers du XXème siècle, notamment en ce qui concerne les maladies transmises par voie hydrique (Salmonelle, Shigella, …). Ceci conduit au premier texte réglementaire, décret du 1er août 1961, définissant avec précision les exigences de qualité auxquelles devraient répondre les eaux destinées à l’alimentation. Sur le plan du risque microbiologique, risque à court terme, la notion de germes test fait son apparition avec Escherichia coli et les streptocoques fécaux.
Le décret 89-3, du 3 janvier 1989, modifié le 10 avril 1990 (décret 90330) va dans le sens d’une plus grande rigueur avec une augmentation du programme d’analyse lorsque la qualité de l’eau de consommation s’écarte des valeurs fixées. Il repose essentiellement sur deux bases juridiques, avec d’une part, les directives européennes 75-440, 79-869 et 80-778 et d’autre part, le Code de la Santé Publique :
- La directive européenne 75-440 vise la qualité des eaux superficielles utilisées pour la production d’eau alimentaire et définit en fonction des moyens techniques de l’époque trois niveaux de qualité, auxquels sont associés trois traitements types.
- La directive 79-869 complète la directive 75-440, en définissant les modalités de vérification de la qualité de ces mêmes eaux superficielles (caractéristiques, méthodes d’analyses, …).
- La directive 80-778 est quant à elle directement relative à la qualité des eaux destinées à la consommation humaine et définit à travers 62 paramètres, des valeurs guides, des concentrations maximales admissibles (CMA) ou des concentrations minimales requises. Les Etats membres fixent leurs normes nationales de qualité en fonction de cette directive, même si les Etats peuvent permettre des dérogations, dans des conditions déterminées dont les Communautés Européennes doivent être informées. Les dispositions pour le suivi de la qualité des eaux distribuées, les analyses types, leurs fréquences et les méthodes y sont fixées.
- Le code de la Santé Publique fixe notamment les règles générales d’hygiène et toutes autres mesures propres à préserver la santé de l’homme, notamment en matière d’alimentation en eau potable.
La directive européenne 80-778 fait dépendre l’aptitude de l’eau à sa consommation que du seul respect des exigences concernant les paramètres pris en compte, alors que le paramètre “absence de pathogènes” est invérifiable. Dans le décret français, “l’exigence de l’absence de signes de dégradation de l’eau” ne résout pas le problème, puisque la présence d’un pathogène, non décelé ou même non décelable, peut ne s’accompagner d’aucun autre signe de dégradation.
Les analyses microbiologiques : nature, fréquence
Paramètres microbiologiques
Pour surveiller la qualité des eaux destinées à la consommation humaine, du point de vue du risque sanitaire, des analyses microbiologiques sont réalisées sur l'eau brute alimentant la station de traitement, sur l'eau traitée en sortie d'usine et sur le réseau, jusqu'aux consommateurs.
Les différents paramètres microbiologiques recherchés sont présentés dans le tableau XI.
| Paramètres | Unités | Limite de qualité pour les eaux potables |
|---|---|---|
| Organismes pathogènes salmonelles staphylocoques bactériophages fécaux entérovirus |
par 5 L par 100 mL par 50 mL par 10 L |
0 0 0 0 |
| Coliformes totaux | à 37°C, par 100 mL | 0 (95% des échantillons conformes) |
| Coliformes thermotolérants | à 44°C, par 100 mL | 0 |
| Streptocoques fécaux | par 100 mL | 0 |
| Spores de germes anaérobies sulfito-réducteurs | par 20 mL | 1 |
| Tableau XI : Paramètres microbiologiques. (Source : décret n°89-3 du 3 janvier 1989, relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles). |
Nature et fréquences des analyses microbiologiques de l'eau potable
Compte tenu des techniques utilisées pour la réalisation des analyses microbiologiques et des coûts de celles-ci, différents types d'analyses microbiologiques sont réalisées :
- Le contrôle de routine (ou analyse sommaire B2) a pour but de fournir, de manière régulière, des informations sur la qualité organoleptique et microbiologique des eaux destinées à la consommation humaine ainsi que des informations sur l'efficacité du traitement des eaux potables (notamment de la désinfection) lorsqu'il est pratiqué, en vue de déterminer si les eaux destinées à la consommation humaine respectent ou non les valeurs paramétriques pertinentes prévues par la Directive du Conseil de l'Union européenne n° 98/83/CE du 03/11/98 relative à la qualité des eaux destinées à la consommation humaine.
- Le contrôle complet (ou analyse complète B3) a pour but de fournir les informations nécessaires pour déterminer si toutes les valeurs paramétriques prévues par la directive mentionnée ci-dessus, sont ou non respectées. Tous les paramètres fixés font l'objet d'un contrôle complet à moins que les autorités compétentes puissent établir que, pendant une période qu'il leur appartient de déterminer, un paramètre n'est pas susceptible d'être présent dans une distribution donnée à des concentrations qui pourraient compromettre le respect des valeurs paramétriques pertinentes.
| Analyses bactériologiques | ||
|---|---|---|
| Réduite (B1) | Sommaire (B2) | Complète (B3) |
| Coliformes thermotolérants Streptocoques fécaux |
Coliformes thermotolérants Streptocoques fécaux Dénombrements des bactéries aérobies revivifiables à 22°C et à 37°C |
Coliformes thermotolérants Streptocoques fécaux Dénombrements des bactéries aérobies revivifiables à 22°C et à 37°C Coliformes totaux Spores de bactéries anaérobie sulfito-réductrices |
| Coliformes thermotolérants | à 44°C, par 100 mL | 0 |
| Streptocoques fécaux | par 100 mL | 0 |
| Spores de germes anaérobies sulfito-réducteurs | par 20 mL | 1 |
| Tableau XI : Paramètres microbiologiques. (Source : décret n°89-3 du 3 janvier 1989, relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles). |
||
Les analyses type B2 sont réalisées au cours de la distribution, que le réseau soit alimenté par une eau souterraine ou une eau superficielle.
Les analyses type B3 sont réalisées au niveau de la production, après le traitement, avant le refoulement ou au point de puisage si il n’y a pas de traitement.
En ce qui concerne les eaux superficielles, outre les analyses bactériologiques de type B1, il est procédé :
- à une recherche annuelle de salmonelles (dans cinq litres d'eau),
-
à une recherche de coliformes dans les conditions suivantes :
- une fois par an pour un débit inférieur à 6 000 m3 /jour,
- deux fois par an pour un débit compris entre 6 000 m3 /jour et 20 000 m3 /jour,
- quatre fois par an pour un débit supérieur à 20 000 m3 /jour.
| Volume d’eau distribué ou produit chaque jour, à l’intérieur d’une zone de distribution (m3) | Contrôle de routine Nombre de prélèvements par an (B2) | Contrôle complet Nombre de prélèvements par an (B3) |
|---|---|---|
| ≤ 100 | fixé par l’Etat membre * | fixé par l’Etat membre * |
| > 100 et ≤ 1000 | 4 | 1 |
| >1000 et ≤ 10 000 | 4 +3 pour chaque tranche entamée de 1 000 m3/j du volume total |
1 +1 pour chaque tranche entamée de 3 300 m3/j du volume total |
| > 10 000 et ≤ 100 000 | 3 + 1 pour chaque tranche entamée de 10 000 m3/j du volume total |
|
| > 100 000 | 10 +1 pour chaque tranche entamée de 25 000 m3/j du volume total |
|
|
*Fréquences annuelles d'analyses microbiologiques, fixées par le décret n°91-527 Tableau XIII : Fréquence minimale des échantillonnages et des analyses pour les eaux destinées à la consommation humaine. (Source : Directive du Conseil de l'Union européenne n° 98/83/CE du 03/11/98 relative à la qualité des eaux destinées à la consommation humaine). |
||
Les indicateurs utilisés en microbiologie de production d'eau potable
Plusieurs indicateurs peuvent être utilisés en microbiologie de production d’eau potable :
Recherche des coliformes totaux
L’analyse des bactéries coliformes totales est la plus fréquente pour le contrôle de l’eau potable, et ce, depuis plus de 100 ans. Son faible coût d’analyse, sa reproductibilité et l'omniprésence des coliformes dans les eaux de surface en font un indicateur universel pour juger de la qualité d’une eau. Ce groupe hétérogène appartient à la famille des entérobactéries et comprend plusieurs genres bactériens se retrouvant dans la flore normale intestinale. Cependant, la plupart des espèces se retrouvent aussi naturellement dans le sol et la végétation. De ce fait, cette analyse n’est pas considérée comme un indicateur de contamination fécale ou de risque sanitaire.
Une eau potable contenant des coliformes totaux indique une insuffisance du traitement et/ou une incapacité à maintenir un résiduel de chlore suffisant dans le système de distribution. Il faut cependant porter une attention particulière à la présence récurrente de coliformes totaux dans un réseau ou un secteur du réseau. Ceci peut signaler la présence d’une pollution de surface à cause d’une déficience de l’intégrité du réseau, de l’efficacité du traitement ou d’une contamination de l’eau brute non traitée. Ces situations doivent être corrigées pour prévenir un risque sanitaire éventuel.
La survie dans l’eau et la résistance au chlore des bactéries coliformes totales est plus faible que celles des virus et des parasites. Ce ne sont donc pas de bons indicateurs de la présence ou de l’efficacité du traitement.
Recherche des coliformes thermotolérants et Escherichia coli
Les coliformes thermotolérants (ou fécaux) sont un sous-groupe de bactéries faisant partie des coliformes totaux. La méthode d’analyse est optimisée pour sélectionner la croissance des bactéries d’origine fécale. L’incubation se fait donc à 44,5°C durant 24 heures dans un milieu spécifique favorisant la croissance de colonies typiques bleutées. Cette température élevée de croissance confère à ce groupe le terme plus judicieux de coliformes thermotolérants. Toutefois, d’après la méthode habituelle, la confirmation de la présence de E. coli peut prendre jusqu’à 48 heures supplémentaires.
Si en plus des bactéries coliformes totales, des bactéries coliformes fécales sont présentes, une contamination d’origine fécale est fortement soupçonnée et un avis d’ébullition doit être émis immédiatement pour protéger la population.
L’analyse des bactéries Escherichia coli, qui représentent environ 90% des bactéries coliformes fécales, confirme sans aucun doute que cette contamination est d’origine fécale. En effet, E. coli est la seule espèce bactérienne faisant partie du groupe des coliformes totaux (et des coliformes fécaux) qui est toujours d’origine fécale humaine ou animale. C’est une bactérie qui est particulièrement sensible à la désinfection et qui a la particularité de se développer difficilement à l’intérieur d’un réseau. Sa présence indique habituellement un traitement inefficace ou une intrusion par un réseau non étanche.
Recherche des Streptocoques fécaux (ou entérocoques)
Les entérocoques appartiennent au même groupe de bactéries, appelées auparavant streptocoques fécaux. À l’instar des E. coli, les bactéries entérocoques se retrouvent en quantité considérable dans les matières fécales humaines et animales. Toutefois, certaines variétés ne sont pas d’origine fécale et peuvent se retrouver dans les végétaux et le sol. Ces bactéries sont plus résistantes à la chloration que les coliformes et survivent généralement plus longtemps dans l’environnement. En outre, contrairement aux coliformes, elles recroissent très mal dans le réseau. Leur haute résistance à la sécheresse permet d’utiliser aussi les entérocoques comme contrôle de routine lors de l’installation ou de la réparation de conduites d’un réseau de distribution.
L’analyse des bactéries entérocoques est souvent réalisée pour évaluer la contamination fécale des eaux de baignade. L’analyse se fait habituellement par membrane filtrante sur un milieu spécifique. Ils peuvent être utilisés comme indicateur de contamination dans une eau souterraine non désinfectée.
Recherche des indicateurs viraux
Des virus entériques humains sont susceptibles de se retrouver dans presque toutes les eaux de surface et dans les eaux souterraines vulnérables. Bien que la résistance des virus à la désinfection soit variable, elle est généralement plus grande que la résistance des bactéries. En conséquence, les indicateurs bactériens ne sont pas très valables pour relever la présence de virus. Dans la moitié des cas d’épidémies d’origine hydrique, les causes sont inconnues, même si l’on soupçonne les virus d’être très souvent responsables.
Les indicateurs viraux mesurent les coliphages somatiques et les coliphages mâles spécifiques. Les coliphages sont une variété de bactériophages qui infecte spécifiquement une espèce bactérienne, soit E. coli. Les coliphages sont présents en plus grande quantité que les virus entériques dans les matières fécales.
L’analyse est basée sur la propriété des coliphages à infecter et à détruire E. coli. Le résultat est exprimé en unités formant des plages de lyse (ufp) par 100 ml d’échantillon. Il existe aussi une méthode qualitative de type présence/absence. Les coliphages servent d’abord d’indicateurs de contamination fécale dans l’eau souterraine, mais aussi de la présence possible de virus entériques, compte tenu de leurs caractéristiques similaires.
Les indicateurs parasitaires
Cryptosporidium est un parasite plutôt petit et compte parmi les plus résistants à la chloration. On estime qu’un traitement efficace pour éliminer de façon sécuritaire ce parasite sera suffisamment efficace contre les autres parasites. Par contre, ils sont plus gros que les bactéries et c’est pourquoi ils ne peuvent contaminer une eau souterraine bien protégée. Très souvent, les épidémies répertoriées pour Cryptosporidium surviennent dans des systèmes à traitement complet ayant démontré une déficience dans le système de filtration.
En raison de contraintes analytiques, il n’y a toutefois aucun contrôle direct de ces microorganismes. Ces analyses sont longues, coûteuses et exigent la filtration d’un grand volume d’eau (jusqu’à 1000 litres). Des recherches sont présentement en cours et il est à prévoir qu’une méthode adéquate sera disponible prochainement.
L’analyse des bactéries sporulantes aérobies (BSA) est un indicateur intéressant pour évaluer la performance d’une filière de traitement d’enlèvement des parasites. Les BSA ne représentent aucun risque sanitaire et sont présentes en abondance dans le sol et toutes les eaux de surface. Elles se cultivent facilement et à faible coût. Après une filtration conventionnelle, le taux d’abattement des spores bactériennes est comparable à celui des oocystes de Cryptosporidium ou est un peu moindre.
Le suivi des particules de petites dimensions (quelques microns) est aussi un outil intéressant pour évaluer la performance de chaque étape du système de filtration en regard de l’enlèvement des kystes et oocystes de Giardia et Cryptosporidium. Le maintien de la plus faible et stable turbidité est un objectif à atteindre. Les contraintes de traitement exprimées en termes de degré d’enlèvement des parasites Giardia et Cryptosporidium sont respectées par le biais d’équivalence selon les technologies de traitement en place.
Ces indicateurs sont comparés, les uns aux autres, sur la base de quatre usages différents (cf. tableau XIV) : le risque sanitaire, la contamination fécale, l’efficacité de traitement et la qualité du réseau.
| Indicateurs | Risque sanitaire | Contamination fécale | Efficacité du traitement | Qualité du réseau | Commentaires |
|---|---|---|---|---|---|
| Escherichia coli | +++ | ++++ | +++ | + | Contamination fécale certaine et récente Risque sanitaire (présence soupçonnée de pathogènes) |
| Coliformes fécaux | ++ | +++ | +++ | + | Contamination fécale probable |
| Coliformes totaux | ± | + | ++++ | ++ | Indicateur standard de la qualité de l’eau distribuée et du traitement (récurrence à surveiller) |
| BHAA | ± | + | ++++ | ++++ | Qualité générale de l’eau distribuée incluant le traitement et la dégradation dans le réseau |
| Colonies atypiques | ± | + | ++++ | +++ | Qualité générale de l’eau distribuée incluant le traitement et la dégradation dans le réseau |
| Entérocoques | ++ | +++ | +++ | + | Contamination fécale probable (doit être utilisé avec E. coli.) |
| Coliphages | ++ | +++ | +++ (virus) | - | Contamination fécale probable; présence de virus potentiellement pathogènes. |
| Bactéries sporulantes aérobies (BSA) | - | - | +++ (parasites) | - | Bon indicateur de l’efficacité du traitement à enlever (filtration) et inactiver (chloration) les parasites |
| Turbidité | +++ | - | ++++ | ++++ | Associé au risque sanitaire global (parasites, virus et bactéries) pour une eau contaminée. |
| Désinfectant résiduel | ± | - | + | ++++ | Avec BHAA, qualité générale de l’eau distribuée (différent de la chloration comme traitement). |
|
Tableau XIV : Description et usage des principaux indicateurs utilisés en microbiologie de l’eau potable (Source : Guide de conception des installations de production d’eau potable, ministère de l’Environnement du Québec, RÉSEAU environnement juin 2001, Version préliminaire) |
|||||
Les bactéries VBNC
Notion de bactéries viables mais non cultivable
Le traitement de l'eau a pour but l'élimination de germes pathogènes présents dans la ressource d'eau brute. La recherche systématique des pathogènes lors des analyses de contrôle étant trop coûteuse, on recherche des germes tests, aussi sensibles au traitement que les germes pathogènes, et témoins de la présence possible de germes pathogènes. Cependant, un certain nombre de microorganismes sont introduits dans le réseau, les procédés de traitements physico-chimiques classiques ne permettant pas d'assurer avec fiabilité une élimination totale des microorganismes.
Cependant, certaines bactéries entrant dans les réseaux de distribution ont résisté au traitement, mais sont plus ou moins affectées par celui-ci. Ces bactéries présentent alors différents états physiologiques allant des bactéries vivantes aux bactéries mortes (cf. figure 12).
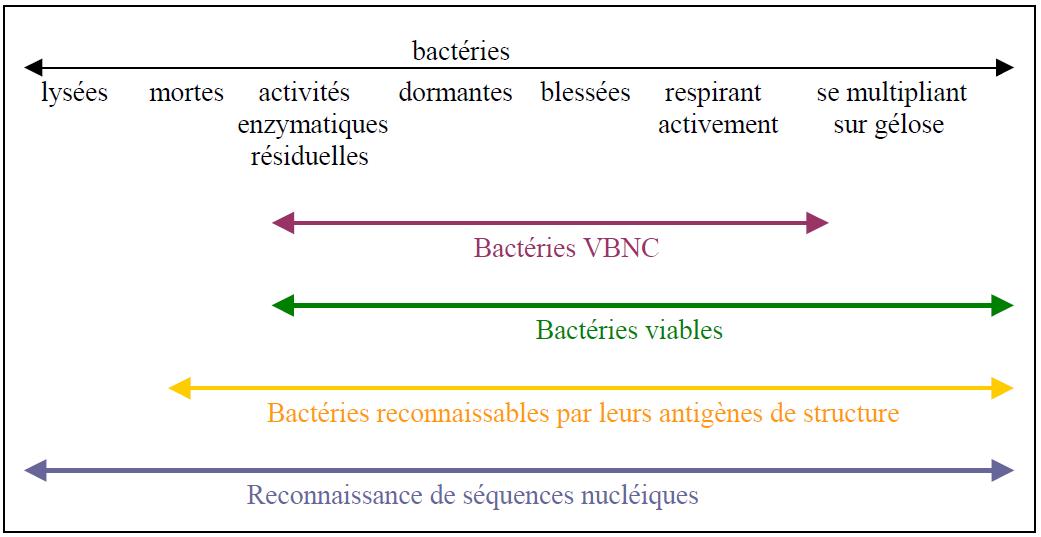
Figure 12 : Classification physiologique schématique des bactéries (Block, 1992)
Ces bactéries, selon leur état physiologique, peuvent avoir perdu :
- leur activité de synthèse protéique,
- leur activité respiratoire,
- leur intégrité membranaire,
- l’intégrité de leur génome.
Conséquences sur le contrôle de la qualité de l'eau potable
Au sein des réseaux, les bactéries, affectées par le traitement de potabilisation, présentent un métabolisme actif, communément utilisés pour les analyses de routine. Or, lors de ces analyses, seule la capacité de reproduction des cellules est considérée comme un indicateur de détermination de la viabilité des microorganismes.
Cependant, moins de 1% des populations bactériennes des milieux oligotrophes, constitués par les réseaux de distribution d’eau potable, peuvent être cultivées sur les milieux de culture couramment utilisés pour les analyses de routine. Ces bactéries sont donc incapables de se développer et de former des colonies sur les milieux nutritifs, bien qu'elles présentant un métabolisme actif.
La technique d’évaluation de la qualité des eaux potables distribuées, basée sur la culture sur milieu gélosé enrichi, des bactéries présentes dans l’échantillon d’eau permet alors de distinguer :
- les bactéries cultivables, qui peuvent former des colonies sur milieu de culture, et qui sont donc considérées comme viables,
- les bactéries non cultivables, c’est à dire les bactéries non détectables par les méthodes de recherche classiquement mises en oeuvre par les pouvoirs publics ou les industriels.
Ainsi, des dénombrements bactériens réalisés à partir d’échantillons d’eau de réseaux de distribution d’eau potable ont été effectués sur différents milieux de culture :
- test normalisé, utilisant une gélose AFNOR, avec une incubation à 22°C, pendant 72 heures,
- test normalisé, utilisant une gélose AFNOR, avec une incubation à 37°C, pendant 24 heures,
- test utilisant une gélose R2A, avec une incubation à 22°C, pendant 7 jours. Cette gélose est moins sélective, car constituée de molécules organiques plus simples, donc plus accessible.
Ces résultats indiquent que, selon le milieu de culture utilisé, le nombre de microorganismes mis en évidence est différent. Ces milieux nutritifs sont donc plus ou moins sélectifs vis-à-vis des microorganismes présents. Une sélection par le temps d'incubation peut également être observable (augmentation du nombre de microorganismes mis en évidence avec le temps d'incubation). Ceci montre la nécessité d'un temps d'adaptation des bactéries lors du transfert d'un milieu oligotrophe (eau potable) à un milieu de culture enrichi.
Ceci peut être expliqué de la manière suivante :
- la majorité des populations bactériennes présentes, ne sont pas viables, les espèces bactériennes ne sont alors pas cultivables sur de tels milieux,
- la majorité des cellules sont viables et actives, mais sont entrées dans un stade métabolique "viable mais non cultivable" (Viable But Non Cultivable VBNC), qui représente une adaptation au milieu oligotrophe.
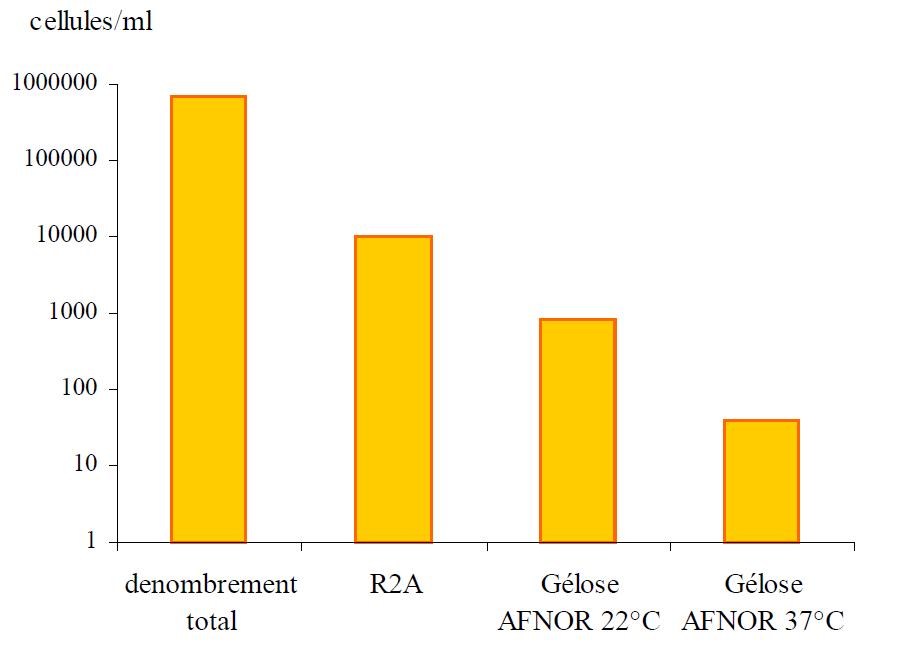
Figure 13 : Comparaison des dénombrements bactériens d’eau de réseau en utilisant les méthodes normalisées (gélose AFNOR 22°C, 72 heures et gélose AFNOR 37°C, 24 heures), des méthodes moins sélectives (gélose R2A 22°C, 7 jours) et le dénombrement total (épifluorescence au microscope).
Or la viabilité des microorganismes est cruciale pour évaluer l'efficacité des traitements d'inactivation. La flore bactérienne identifiée par des techniques classiques de comptage de flore sur gélose n'est pas représentative des bactéries effectivement présentes dans l'eau produite, et notamment les bactéries blessées et stressées par le traitement.
Or la viabilité des microorganismes est cruciale pour évaluer l'efficacité des traitements d'inactivation. La flore bactérienne identifiée par des techniques classiques de comptage de flore sur gélose n'est pas représentative des bactéries effectivement présentes dans l'eau produite, et notamment les bactéries blessées et stressées par le traitement.
Cela souligne la non-adaptation des milieux de cultures aux bactéries, ce qui se traduit par un écart entre le nombre de bactéries totales et le nombre de bactéries cultivables. Or la présence de bactéries VBNC dans l'eau issue de l'usine de traitement induit un risque de reviviscence bactérienne dans le réseau de distribution et par la suite la formation de biofilms.
De plus, ces bactéries gardent leur éventuel pouvoir pathogène, ce qui peut avoir pour conséquence une contamination microbiologique des consommateurs.