LES CLES DU DIMENSIONNEMENT
Ouvrages en commandePhotovoltaïque autonome
Photovoltaïque raccordé au réseau

Formations Professionnelles Photovoltaïques
Facteurs contrôlant la Reviviscence Bactériennee > La désinfection
Principe
La désinfection est l’étape ultime de la filière de traitement de l’eau destinée à la consommation humaine. Son but est l’élimination des germes pathogènes, des virus, de la majeure partie des germes banals, dans un souci de respect des normes de potabilité de l'eau. La désinfection des eaux comporte deux critères importants, correspondant à deux effets différents d’un désinfectant donné :
- un effet bactéricide, qui correspond à la capacité à détruire les germes en une étape donnée du traitement,
- un effet rémanent, qui correspond au maintien du désinfectant dans le réseau de distribution. La rémanence d’un oxydant au sein du système de distribution permet de garantir la qualité bactériologique de l’eau au cours de la distribution. Il s’agit à la fois d’un effet bactériostatique contre les reviviscences bactériennes en réseau et d’un effet bactéricide contre des pollutions faibles et ponctuelles survenant sur le réseau.
La demande en désinfectant
La réaction de l'oxydant au sein du réseau de distribution entraîne la diminution de sa concentration résiduelle. Cette consommation dépend de différents facteurs : la température, la concentration en désinfectant, le temps de résidence hydraulique, le régime hydraulique régnant dans le réseau, le diamètre des canalisations.
Le chlore réagit également avec la matière organique présentes dans la phase aqueuse, avec la surface des conduites, et les dépôts présents sur les parois des conduites (Parent et al., 1996) :
- réaction au niveau de la phase aqueuse, avec la matière organique contenue dans l'eau ; la réaction dépend alors de la concentration en désinfectant et de celle en matière organique,
- réaction à la surface des conduites, avec les matériaux constitutifs des conduites, qui dépend du rapport surface/volume et de la concentration en chlore,
- réaction avec le biofilm, qui dépend du nombre de sites actifs de celui-ci, de la consommation de chlore, de la concentration en chlore, ainsi que de sa surface spécifique.
Oxydants utilisés en désinfection de l'eau potable
Afin d’évaluer la performance de la désinfection, trois groupes d’organismes cibles sont testés. Il s’agit des virus entériques, des kystes de Giardia et des oocystes de Cryptosporidium. Le choix de ces organismes repose sur les constats suivants :
- ils sont détectés couramment dans les eaux de surface des lacs et des rivières et parfois même dans les eaux souterraines,
- ils ont été à l’origine d’épidémies confirmées, certaines touchant des dizaines de milliers d’individus,
- ils offrent une grande résistance à la désinfection. Leur élimination permet donc de supposer qu’il en va de même pour tous les autres micro-organismes pathogènes moins résistants.
Le tableau VII présente les CT requis pour l'inactivation des organismes cités ci-dessus.
Cinq choix sont possibles pour améliorer l'efficacité de la désinfection :
- augmenter la concentration de désinfectant résiduel à la sortie des bassins de contact
- augmenter le temps de contact dans les bassins en augmentant le volume et, par conséquent, le temps de contact dans les bassins,
- changer de type de désinfectant puisque certains désinfectants, ont une efficacité relative plus importante,
- changer les conditions d’application du désinfectant (pH et température de l’eau) afin de travailler dans les meilleures conditions possibles d’efficacité du désinfectant utilisé.
| Désinfectant | Virus 2 log d'inactivation |
Giardia 2 log d'inactivation |
Cryptosporidium |
|---|---|---|---|
| Chlore1 | 3 | 69 | 7 200 (2 log) |
| Monochloramines2 | 643 | 1 230 | Les monochloramines ne sont pas efficaces pour inactiver Cryptosporidium |
| Dioxyde de chlore3 | 4.2 | 15 | 249 (1 log) |
| Ozone | 0.5 | 0.95 | 9,9 (1 log) |
| Tableau VII : Liste des CT (mg.min.L-1) requis, selon le type d'oxydant, pour l'inactivation d'un organisme cible (Source : USEPA, 1999) | |||
2 Valeurs obtenues à 10°C, pour une gamme de pH de 8.
3 Valeurs obtenues à 10°C, pour une gamme de pH de 6 à 9.
Irradiation UV
L'effet bactéricide des rayonnements UV est provoqué par le peroxyde d'hydrogène ou les radicaux d'oxygène produits par les réactions photochimiques pendant l'irradiation des substances présentes dans l'eau. L'avantage de l'irradiation UV est qu'elle n'entraîne pas la formation de sous-produits de désinfection ou de résidus. L’effet germicide optimum correspond au spectre d’UV allant de 245 à 285 nm.
D'une manière générale, une dose comprise entre 20 et 25 mW.s.cm-2 semblerait suffisante pour obtenir une désinfection efficace du point de vue de la potabilisation (cf. tableau VIII).
| Organismes cibles | Dose pour l'inactivation Organismes cibles des organismes cibles (mJ.cm-2) | |
|---|---|---|
| 2 log | 3 log | |
| Cryptosporidium Giardia Virus |
Non déterminé 30-40 21 |
20-30 Non déterminé 36 |
| Tableau VIII : Dose nécessaire pour l'inhibition d'organismes cibles par irradiation UV. | ||
De plus, la désinfection par l'irradiation UV (également comme l'ozone) est un procédé oxydatif qui augmente la formation de carbone organique dissous facilement biodégradable dans l'eau. En effet, l'utilisation de l'ozone et des radiations UV sur des eaux contenant des molécules organiques complexes conduit à la production de substances organiques de plus faibles masses molaires, donc plus facilement biodégradables et pouvant promouvoir la formation de biofilm dans les réseaux de distribution.
Chlore
Le chlore est un désinfectant très efficace pour l'inactivation des bactéries et notamment des bactéries pathogènes telles que E. coli, Pseudomonas aeruginosa, Salmonella tiphi et Shigella dysenteriae. Cependant, il présente une pénétration limitée dans le biofilm et le maintien d’un résiduel de chlore approprié à un effet limité sur la croissance bactérienne. De plus, il présente une efficacité limitée pour l'inactivation des protozoaires. Ainsi, des CT de 30 à 3 600 mg.min.L-1 de chlore ne permet qu'une inactivation de 40% (0,2 log) des Cryptosporidium (Finch et al., 1994). L'utilisation du chlore a donc peu d'impact sur la viabilité de Cryptosporidium, aux doses habituellement appliquées en traitement de désinfection.
De plus, la réaction du chlore avec les composés organiques conduit à la formation de sousproduits, les trihalométhanes (THM), supposés être cancérogènes.
Monochloramines
L’utilisation de monochloramines présente plusieurs avantages par rapport au chlore. Elles ne réagissent pas autant que le chlore avec la matière organique telle que les sucres et les polysaccharides extracellulaires, mais réagissent plus spécifiquement avec les acides nucléiques, tryptophane et acides aminés soufrés. Les monochloramines présentent donc une meilleure rémanence dans les réseaux de distribution. De plus, comme les monochloramines sont moins réactives, la formation de sousproduits est amoindrie. Cependant, un inconvénient des monochloramines est qu’elles nécessitent des CT plus longs ou des concentrations plus importantes pour obtenir des résultats similaires à ceux obtenus avec le chlore. Ainsi, une concentration de monochloramines de 0,3 mg.L-1 nécessite 240 minutes de temps de contact pour 3 log d'inactivation d'E. coli, contre 0,14 mg.L-1 de chlore libre pendant 5 minutes pour obtenir le même niveau d'inactivation, à température et pH égaux (Wattie et al., 1944). La même observation est faite pour l'inactivation des virus (Kelley et al., 1960) et des protozoaires (Stringer et al., 1970).
Dioxyde de chlore
Le dioxyde de chlore est un oxydant et un désinfectant puissant, efficace pour l'inactivation des bactéries, virus et protozoaires pathogènes. Cependant les mécanismes qui gouvernent son action désinfectante ne sont pas encore bien connus et ils semblent différer selon le type de microorganisme. Le dioxyde de chlore ClO2 présente plusieurs avantages comparativement au chlore et aux autres désinfectants.
Tout d'abord, contrairement au chlore, il demeure sous sa forme moléculaire dans les limites de pH typiques des eaux naturelles.
De plus, plusieurs études indiquent que le dioxyde de chlore est autant voire plus efficace que le chlore pour inactiver certaines bactéries, telles que B. subtilis, B. mesentericus, et B. megatherium (Ridenour et al., 1949), et les cystes de protozoaires (Chen et al., 1985 ; Sproul et al., 1983). Cependant, le CT requis pour une inactivation de 2 log des protozoaires est supérieur à ceux habituellement appliqués en désinfection (0,07 à 2,0 mg.L-1).
Cependant, bien que l'utilisation du dioxyde de chlore permette de réduire la formation de THM, il entraîne la formation d'autres sous-produits de désinfection, tels que les chlorites et chlorates. De plus, la désinfection au dioxyde de chlore est généralement plus cher et plus compliquée à effectuer que celle du chlore, celui-ci devant être synthétisé sur place.
Phénomènes de résistance aux désinfectants
La résistance des biomasses fixées aux oxydants s’explique par :
- la consommation de l’oxydant par le biofilm lui-même, du à son pouvoir réducteur, de la matière organique fixée,
- une pénétration limitée du chlore jusqu’aux couches basales du biofilm, à l’origine d’un gradient de concentration en désinfectant depuis les couches superficielles vers les couches plus profondes,
- la densité cellulaire du biofilm,
- la nature du matériau support.
- élimination de l’oxydant : superoxyde dismutase, catalase,
- protection vis-à-vis de l’oxydant : gluthation (GSH),
- réparation des dommages : système SOS, système Heat Shock.
Cette résistance aux désinfectants est également observable pour les protozoaires véhiculés par l’eau. Ainsi, Tetrahymera pyriformis (cilié) résiste à l’exposition à une dose de désinfectant résiduel allant jusqu’à 4 mg.L-1 (pH = 7, 25°C) , pendant 30 minutes. Celui-ci reste cultivable après une exposition pendant 24 heures à un résiduel de chlore variant de 0,5 à 2 mg.L-1 (Sibille, 1998).
Les amibes, pour résister aux agressions environnementales, peuvent s’enkyster. Ce phénomène est observable pour des concentrations en chlore de l’ordre de 4 mg.L-1 (King et al., 1988). Ainsi, Acanthamoebae castellanii (amibe) survit à des doses de chlore résiduel de l’ordre de 10 mg.L-1.
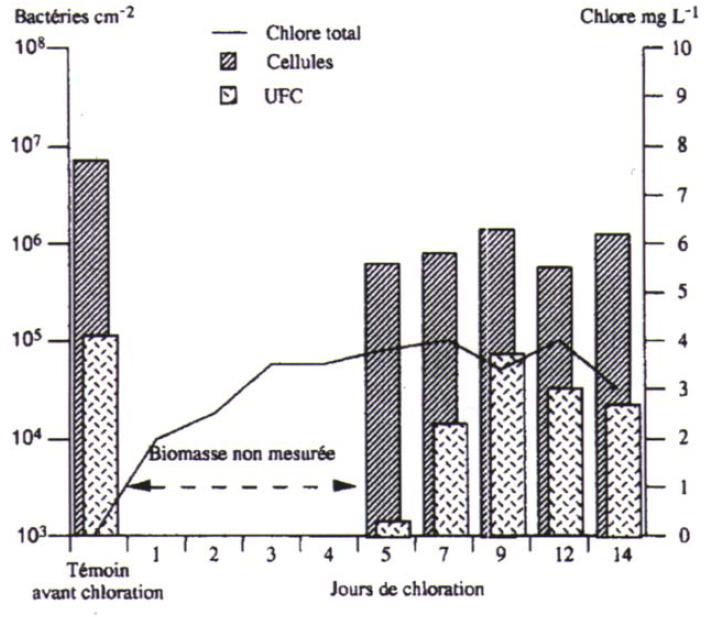
Figure 11 : Evolution de la densité bactérienne totale et des bactéries cultivables fixées, dans un réseau expérimental de distribution alimenté avec une eau CAG chlorée en continu pendant 14 jours (Paquin et al., 1992)
La résistance des microorganismes aux désinfectants peut entraîner une augmentation de la dose de désinfectants appliquée. Cependant, la formation de sous-produits liée à l'utilisation de ces désinfectants (THM pour le chlore ; chlorites, chlorates pour le dioxyde de chlore) ne permet une augmentation trop importante des doses de désinfectants, celle-ci s'accompagnant d'un risque de dépassement des normes de potabilité pour les sous-produits. Cependant, l’application de fortes concentrations de chlore en sortie d’usine est incompatible avec les normes en résiduels et en dérivés chlorés (sous-produits de désinfection).
Ceci implique un contrôle de la reviviscence bactérienne en réseau par d'autres moyens que l'utilisation de désinfectants.