LES CLES DU DIMENSIONNEMENT
Ouvrages en commandePhotovoltaïque autonome
Photovoltaïque raccordé au réseau

Formations Professionnelles Photovoltaïques
Méthode d'échantillonnage des moisissures de l'habitat > Dans l'air
Les techniques de recueil ont pour objet de séparer les particules du flux d'air pour les recueillir sur un ou plusieurs milieux sélectionnés. Les quatre méthodes utilisées sont la sédimentation, l'impaction sur support adhésif ou sur milieu de culture solide en boite de Pétri, l'impaction en milieu liquide et la filtration.
La sédimentation
C’est une technique ancienne qui a été très répandue et a constitué une approche simple de l’aérocontamination. Cette technique consiste à exposer de façon passive un support nutritif ou non (boite de Pétri, plexiglas, gel) à la chute naturelle des spores sous l’effet de la gravitation. Outre les avantages liés à un coût faible, à l’absence d’appareillage, cette technique permet d’exposer les supports pendant des durées importantes dans la limite toutefois de la dessiccation des gels et des milieux. Cependant le volume d’air ainsi traité n’est pas mesurable et dépend largement des flux au sein de l’espace échantillonné. Les inconvénients principaux qui ont fait abandonner cette méthode sont liés à la remise en suspension des spores les plus petites favorisant la sélection des spores les plus volumineuses. La reproductibilité de ce type d’échantillonnage est faible. Son usage est aujourd’hui abandonné.
L’impaction
Les propriétés d’inertie des particules sont souvent utilisées pour les extraire d’un écoulement transportant un aérosol. En effet dans le cas d’un écoulement curvilinéaire, l’inertie provoque la déviation des particules des lignes de courant du fluide. Ce mécanisme est mis en oeuvre, notamment dans les impacteurs au sein desquels l’air est brusquement accéléré par passage au travers d’une section réduite et brutalement dévié par une surface de collection solide (gélose ou surface adhésive) ou liquide. Les particules selon leur inertie vont, soit suivre les lignes de courant, soit s’impacter sur la surface de collection pour celles possédant l’inertie la plus importante.
L’impaction dépend de plusieurs facteurs tels que la taille, la densité et la vélocité initiale des particules ainsi que des paramètres physiques du dispositif de collecte (dimension de la buse, débit du gaz porteur, distance entre la buse et la surface de collection).
L’efficacité physique de ces biocollecteurs peut être figurée par le diamètre de coupure d50 qui correspond au diamètre aérodynamique des particules à partir duquel toutes les particules de diamètre supérieur sont théoriquement collectées.
Le diamètre de coupure est défini par :
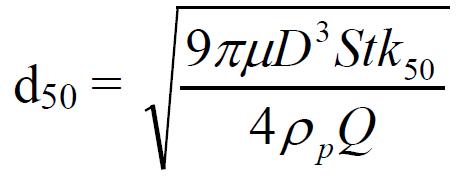
Où :
- n : Nombre de trous
- ρp : masse volumique du fluide (m3/s)
- µ : viscosité dynamique du fluide (kg/m.s)
En réalité, des particules de diamètre inférieur à d50 sont également recueillies :
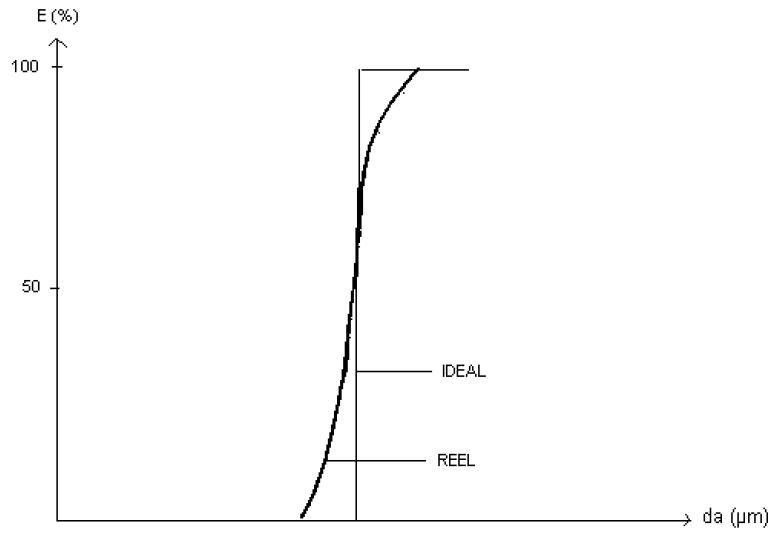
Courbes d'efficacité de collection
L’impaction sur support adhésif
Les impacteurs sur support adhésif (par exemple les capteurs de Hirst) permettent la capture des spores en continu sur plusieurs jours, voire une semaine. L’air est aspiré à un débit de 10 L/min à travers une fente (Ex Spore Traps). Les particules sont projetées sur une surface adhésive. La vitesse du tambour qui présente l’adhésif face à la fente conditionne la durée du prélèvement ainsi que le nombre de particules capturées. L’identification des champignons se fait au moyen d’une lecture microscopique directe des bandes adhésives. Elle se limite, même avec un personnel entraîné et formé, à quelques genres de champignons dont les spores sont morphologiquement reconnaissables (Alternaria, Dreschlera, Cladosporium, Ustilago, Epicoccum…). Les genres comme Penicillium et Aspergillus, aux spores de morphologies et de tailles similaires sont confondues. Ces appareils sont de surcroît volumineux et électriquement non autonomes.
L’impaction sur milieux en boite de Pétri
Un impacteur est constitué d'une plaque perforée d'orifices, à travers lesquels passe le flux d'air aspiré, et d'une surface de collecte (généralement un milieu de culture gélosé). Les impacteurs en cascade type appareil d’Andersen comportent plusieurs étages (2 à 6) dont les orifices ont des diamètres de plus en plus faibles pour recueillir des particules de plus en plus petites (> 9,2µm; 5,5 à 9,2µm; 3,3 à 5,5µm; 2 à 3,3µm; 1 à 2 µm; > 0,58µm). A chaque étage, un milieu de culture gélosé stérile en boîte de Pétri est inséré. Ce système permet d’utiliser plusieurs sortes de milieux de culture, plus ou moins sélectifs et d’obtenir une séparation granulométrique des particules contaminées (N.B. On peut aussi utiliser des filtres qui seront ensuite traités comme ceux des systèmes de recueil par filtration).
Les colonies sont dénombrées et identifiées. Pour les impacteurs comportant plusieurs cribles, il existe un facteur de correction (table de correction), basé sur le fait que plusieurs particules peuvent passer par le même orifice, s'impacter au même endroit mais ne donner naissance qu'à une seule colonie visible.
Parmi les impacteurs en milieu solide, il existe différents systèmes conçus pour accélérer le flux d’air et permettre l’impaction des particules à la surface du milieu de culture solide :
- impacteurs à cribles ;
- impacteurs à fentes dans lesquels l’air est accéléré par passage au travers d’une ou plusieurs fentes positionnées au dessus du milieu de culture ;
- impacteurs centifuges où les particules sont projetées par la force centrifuge d’une hélice sur le milieu nutritif.
Choix du biocollecteur
Une revue générale cite 94 articles concernant l'évaluation d'un total de 101 biocollecteurs différents. Globalement, ces études comme d'autres plus récentes tendent à montrer que l'impacteur Andersen est l'appareil le plus performant (ses différentes versions avec 1, 2 et 6 étages), tant sur le plan de l'efficacité de collecte que sur celui de la reproductibilité. C'est cet appareil qui est recommandé et utilisé dans les études à large échelle aux Etats-Unis. Toutefois, les inconvénients de ce type de dispositif restent nombreux avec notamment un débit considéré par de nombreux utilisateurs comme insuffisant (28,3 L/min), une absence d’autonomie électrique, une ergonomie déficiente qui ont conduit à la production de nouveaux appareils corrigeant ces défauts tout en maintenant les principes de base (Air-Test Oméga (LCB), MAS 100 (Merck), M Air T (Millipore), Bio-impactor (Iroise) avec débits de l'ordre de 100 L/min, maniable, autonome pompant jusqu’à 1000L, avec départ différé, mais sans sélection granulométrique). Pour l'instant aucune étude sur l'efficacité et la validité de ces appareils n'est publiée.
Les autres impacteurs classiquement cités dans la littérature sont les suivants :
- L'impacteur rotatif RCS Biotest, intéressant pour sa maniabilité (format torche, silencieux, dispositif d'aspiration incorporé, léger, tête autoclavable), mais peu efficace pour les particules de diamètre inférieur à 3,8 µm.
- Le RCS Plus, version révisée du RCS, avec séparation des flux d'air entrant et sortant est lui aussi moins performant que l’Andersen.
- Le SAS (Surface Air System) : impacteur à orifices (2 versions existent : 220 et 260 orifices). Débit : 90-180 L/ min. Une étude a montré une faible efficacité de collecte (entre 1 et 50% selon les particules testées).
- L'impacteur Casella à fente(s) opère à un débit de 30 à 700 L/ min. Il comporte une à quatre fentes rectangulaires (débit de 700 L/min) ; un plateau horizontal supportant la boîte de recueil tourne à vitesse constante sous la (les) fente(s), pour répartir les colonies sur la boîte.
Les impacteurs en milieu liquide ou impingers
Les impingers sont des impacteurs utilisant un liquide comme milieu de recueil. L'air passe à travers le liquide par un tube capillaire. Les particules sont capturées dans le liquide qui peut être une simple solution saline tamponnée, ou contenir des additifs tels que protéines, agents anti-mousse ou anti-gel pour limiter l'altération des cellules, notamment par choc osmotique.
Après collecte, le liquide peut être filtré et le filtre ensemencé sur milieu gélosé, ou dilué.
Deux impingers sont classiquement cités dans la littérature : l'AGI 30 et le Greenberg-Smith. Leurs débits respectifs sont de 12,5 et 28,3 L/min. Un nouveau système combinant impaction et centrifugation (Biosampler) a été conçu pour minimiser les pertes et le ré-entrainement des particules. Ses performances physiques et microbiologiques seraient meilleures que celles de l'AGI 30.
Cette méthode en milieu liquide permet des prélèvements de longue durée grâce à la possibilité de dilution des échantillons (pas de problème de saturation comme pour l’utilisation d’impacteur en milieu solide), mais n’est pas adapté aux spores fongiques, souvent hydrophobes, qui flotteront à la surface et seront ré-entrainées dans le flux d'air sortant. Certains agrégats sont dissociés. Enfin lorsque le milieu choisi est un milieu nutritif, les micro-organismes piégés commencent leur multiplication pendant la phase de transport de l’échantillon sauf à utiliser un dispositif réfrigérant. D’un point de vue pratique, les impingers sont des appareils en verre donc fragiles.
Filtration
Le principe de recueil des particules est l'interception à la surface du filtre, ce qui permet de collecter efficacement des particules de diamètre inférieur à la taille des pores du filtre (diamètre des pores variables de 0,01 à 10 µm). Par exemple un filtre de porosité 5 µm collecte les particules de 0,3 µm avec une efficacité supérieure à 95%.
Le filtre peut être fibreux (fibres de verre) ou membraneux (ester de cellulose, chlorure de polyvinyle, polycarbonate, téflon). Ils peuvent être enduit d’une substance collante (PVC + vaselinetoluène) pour piéger les spores. Les filtres sont placés dans des cassettes porte filtres. Le prélèvement peut se faire « cassette totalement ouverte » (ensemble des particules) ou «cassette partiellement ouverte» (ouverture de 4 mm avec débit de 1 à 2 L/min, pour ne collecter que la fraction inhalable des particules, de diamètre centré autour de 20 µm, inférieur à 100 µm). Les cassettes filtrantes sont reliées à des pompes aspirantes de faible débit (classiquement 1-5 L/min) de type Gilian air.
Des filtres en gélatine existent également. Ils sont généralement disposés dans des porte-filtres prêts à l’emploi. Ils ont une texture fibreuse.
Après recueil, les filtres peuvent être :
- soit examinés directement au microscope ;
- soit disposés sur un milieu de culture gélosé directement (les colonies se développent sur le filtre);
- soit rincés dans un liquide stérile, lequel est ensuite dilué en série et chaque dilutionensemencée sur milieu de culture (0,1 - 0,2 ml par boîte). Après incubation, les colonies sont dénombrées et identifiées. Les concentrations par mètre cube sont calculées à partir du facteur de dilution et du volume d'air prélevé.
Contrairement aux impacteurs, ces systèmes permettent des prélèvements pour une numération de longue durée (8h). L'utilisation des dilutions en série permet de s'affranchir du problème de "saturation" (étable, fromagerie…) inhérent à l'impaction, mais favorisent les populations microbiologiques prédominantes aux dépens de celles faiblement représentées.
Sur le plan de l'efficacité, l'utilisation de dilutions conduit à des dénombrements supérieurs par rapport à une impaction ; ceci est dû à la dispersion par la mise en suspension et l'agitation d'agrégats contenant plusieurs micro-organismes, qui n'auraient donné qu'une seule colonie par impaction. Le liquide peut être utilisé pour des analyses de type biochimique.
Précipitateur électrostatique
En 2002, Willeke et coll. développent un précipitateur électrostatique adapté à la collecte des microorganismes aéroportés. La collecte des particules repose alors sur leurs charges électriques, qu'elles soient produites naturellement ou artificiellement. Dans un précipitateur électrostatique conventionnel, l'aérosol, une fois chargé grâce à un ioniseur d'air, est soumis à un champ électrostatique. Les particules, par passage au travers d'un champ électrostatique, vont, selon leur charge, suivre ou quitter le flux d'air porteur et venir s'impacter sur une surface de collection.